 |
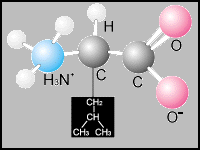
Leucina |
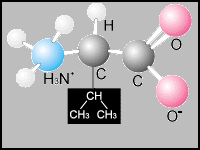 |
Valina |
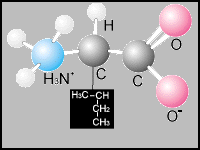 |
Isoleucina
|
Queda claro entonces que tienen que aprenderse todo esto de memoria.
|
Ambos tipos de aminoácidos son producidos en rutas metabólicas con actividades enzimáticas estrictamente controladas. Debido a que las plantas deben producir todos los 20 aminoácidos requeridos para la síntesis de proteínas, cualquier producto químico que inhiba la producción de aminoácidos tendrá propiedades herbicidas.
|
ESTRUCTURA GENERAL DE LAS PROTEÍNAS
General
Arriba
hemos descripto la estructura de los 20 aminoácidos encontrados en las
proteínas y la manera principal en que estas unidades se unen mediante los
enlaces peptídicos. Examinaremos, a continuación, cómo una secuencia lineal de
aminoácidos genera una molécula proteica con una forma tridimensional única. La
complejidad de la estructura proteica se analiza mucho mejor si se considera a
la molécula en términos de cuatro jerarquías organizativas, es decir,
estructuras primaria, secundaria, terciaria y cuaternaria.
Estructura primaria de
las proteínas
La
secuencia de aminoácidos en una proteína se conoce como estructura primaria. La
determinación del orden de aminoácidos en una cadena polipeptídica requiere la
utilización de diversas técnicas experimentales. Primero, se analiza la
composición en aminoácidos, es decir, el tipo y la cantidad de aminoácidos
presentes en la proteína y se tabula. Luego, se determina la identidad de los
aminoácidos en los extremos de la proteína. Finalmente, el polipéptido original
se corta específicamente en fragmentos más pequeños, cuyas secuencias pueden
ser determinadas. Estos fragmentos pueden, luego, ser ordenados para
reconstruir la secuencia del polipéptido original. Veamos estas técnicas:
A. Composición
aminoácidica de los polipéptidos:
1.
Hidrólisis ácida: El
primer paso para determinar la estructura primaria de una proteína es
identificar y cuantificar sus constituyentes. La proteína o polipéptido a ser
analizados se hidrolizan, primero, por tratamiento con ácido fuerte a 110°
durante 24 horas. Este tratamiento rompe las uniones peptídicas y libera los
aminoácidos individuales. Además, la glutamina y asparragina (o asparagina) se
hidrolizan a glutamato y aspartato, respectivamente, mientras que el triptofano
se destruye casi por completo.
2.
Cromatografía: Los
aminoácidos individuales, obtenidos por hidrólisis ácida de la proteína, se
separan por cromatografía de intercambio iónico. En este método, se siembra una
mezcla de aminoácidos sobre una columna que contiene un intercambiador iónico
insoluble. En las condiciones acídicas empleadas, todos los aminoácidos poseen
una carga positiva y quedan unidos a la columna de intercambio que posee una
carga negativa. Cada aminoácido es liberado, secuencialmente, de la columna
cromatográfica mediante elución con soluciones de fuerza iónica y pH
crecientes. A medida que el pH aumenta, los aminoácidos pierden protones,
primero de los carboxilos y, luego, de las cadenas laterales y grupos amino. Al
ir perdiendo los protones, los aminoácidos se vuelven más negativos y se
liberan de la resina. Cada aminoácido eluirá de la columna a un pH y fuerza
iónica específicos.
3.
Análisis cuantitativo:
Los aminoácidos separados, encontrados en el eluido de la columna, se analizan
cuantitativamente por calentamiento con ninhidrina, un reactivo que forma un
compuesto de color azul con la mayoría de los aminoácidos, amoníaco y aminas
(pero forma un derivado amarillo con el nitrógeno imino de la prolina). La
cantidad de cada aminoácido se determina espectrofotométricamente, determinando
la cantidad de luz absorbida por el derivado de ninhidrina. Se registra en
forma continua la absorbancia de cada derivado de aminoácido en un registrador.
Cada pico en el registrador corresponde a un aminoácido individual; el área
debajo de cada pico es proporcional a la cantidad de ese aminoácido en
particular, presente en el polipéptido original. La composición en aminoácidos
se informa como residuos de cada uno por molécula proteica. El análisis, así
descripto, se realiza, generalmente, mediante un analizador automático.
B.
Determinación del aminoácido N-terminal.
1.
Método de Sanger:
Están disponibles diversos métodos para identificar al aminoácido localizado en
el extremo amino terminal de la cadena polipeptídica. En el método de Sanger,
el fluorodinitrobenceno reacciona con los grupos a-amino de los aminoácidos
N-terminales, para formar un dinitrofenil-derivado (DNP) del aminoácido. La
unión entre el grupo DNP y el aminoácido no se rompe por hidrólisis ácida
suave. De este modo, el aminoácido que se ha transformado en el derivado DNP,
puede ser aislado luego de la hidrólisis del polipéptido. El derivado DNP del
aminoácido, que corresponde al extremo amino terminal, puede ser identificado
por cromatografía de intercambio iónico.
2.
Reactivo de Edman:
También puede utilizarse el fenilisotiocianato, conocido como reactivo de
Edman, para marcar el aminoácido N-terminal. El derivado de feniltiohidantoína
(PTH) formado, puede ser clivado en forma específica del polipéptido, sin
perturbar al resto de los enlaces peptídicos entre los restantes residuos
aminoacídicos. El reactivo de Edman posee una ventaja frente al reactivo de
Sanger: puede ser aplicado sucesivamente sobre el polipéptido acortado en el
paso anterior. Usando técnicas automatizadas, la repetición de este método
puede utilizarse para determinar la secuencia de más de 100 aminoácidos,
comenzando desde el extremo N-terminal.
C.
Determinación del aminoácido C-terminal.
1. Hidrazina: Todos los grupos carbonilo, unidos
en enlace peptídico, reaccionan con hidrazina para formar hidrazonas. Sin
embargo, el aminoácido C-terminal no reacciona con la hidrazina y, por lo
tanto, es liberado sin modificación y puede ser separado de los residuos
modificados e identificado.
2. Carboxipeptidasa: Esta exopeptidasa cliva,
secuencialmente, los enlaces peptídicos comenzando desde el extremo C-terminal.
El aminoácido C-terminal será, por lo tanto, el primer aminoácido liberado por
la carboxipeptidasa.
D.
Ruptura de los polipéptidos en fragmentos pequeños.
Lo que aparece acá (Mr) es peso
molecular, la constante de acidez del grupo ALFA carboxilo, la constante de
acidez del grupo amino y la constate de acidez de otro grupo que es
deprotonable, que cuando lo tenga no todos tienen que tener grupos
deprotonables, por ejemplo acá tenemos 10.07 de la tirosina y la verdad es que
es bien poco deprotonable la cadena lateral de la tirosina.
En este otro caso tenemos el
aspartato que parece nombrado como si fuese un acido carboxílico deprotonado
con su base conjugada por lo tanto y puede ser nombrado como acido aspartatico y aparece con 3,65 para su cadena lateral.
Si ustedes tienen dos grupos
deprotonables y hay dos constantes de acidez, digamos grupo 1 K1 y grupo 2 K2.
Si K1 es mayor que K2 cual pierde el protón
con mas facilidad? K1 pierde el protón con mas facilidad que k2 (no más rápido
sino que con mas facilidad).
Que lo pierda con mayor facilidad
no significa que lo tenga el otro grupo como que lo suelta pero no lo suelta,
si no que el grupo de mayor K predomina mas las especies acidas que las bases
conjugadas. Es mas predominable las sustancias acidas de K1. el grupo 2 es
menos deprotonable que el grupo 1.
Si entienden eso… ahora: Cuál
tiende entonces a perder más fácil su protón el que tiene su PK mayor o
menor? PK menor. Si lo entendieron para
dos lo entendieron para tres (K).
Qué mas sale a acá, el punto
isoeléctrico, que es un valor de pH, en
el cual esta molécula no tiene carga, por lo tanto la caga neta es cero.
Y el indice de hidropatia que
esta acá es un valor asociado al aminoácidos que significa que entre mayor es,
mas hidrofóbico será. Entonces entre mas negativo es, mas afín por el agua es.
También aparece el indice de
ocurrencia en la proteína. Algunos aminoácidos son mas frecuentes, es como un
indice estadístico, pero las proteína en general, tienen prácticamente todos los aminoácidos
(en general, pero siempre hay excepciones).
Autorreflexión de Dino Salinas “el
estudiante” respecto de esta tabla:
Hay una tabla, que contiene 20 aminoácidos,
que son los aminoácidos estándares, que tienen distintos parámetros
importantes, entre ellos son los PK hay aminoácidos que tienen 2 o 3 PK, y se van a deprotonar en orden
creciente de los PK. También tienen pesos moleculares determinados y también
aparece un indice de hidropatia, que me indica que tan hidrofobico es, entre
mayor es mas hidrofobico, entre menor es mas hidrofilico y los aminoácidos
tienen distinta ocurrencia en las proteínas.
La tendencia de los aminoácidos a agruparse en
las proteínas, es juntarse en cuanto a su hidrofobicidad, los aminoácidos
tienden a juntarse con aminoácidos parecidos en cuanto a su indice de
hidropatia.
Los aminoácidos están
determinados por el código genético, basado en los codones, que son tres nucleótidos
para forman un aminoácido y como las mutaciones son cambios en las bases… qué
seria conveniente para mantener el indice de hidropatía, si lo que codifica a
un aminoácido sea similar el código a lo que codifica al aminoácido que es
parecido en cuanto al indice de hidropatia. Por ejemplo si quiero cambiar la
tirosina por la fenilalanina, y ambos tienen indice de hidropatia parecido, yo esperaría
que el código genético que determina la tirosina sea similar al que determina a
la fenilalanina, para que varíe en una base tal vez, ojala. Es interesante ya
que significa que esta búsqueda de similaridad de códigos en la naturaleza aun
no ha determinado en el código genético pueda utilizarse otro, para que yo
produzca un error que puede ser una sustitución
de una base obtenga el aminoácido parecido y así la proteína no cambia y
no hay impacto en la estructura o función. La sustitución permite que cuando
cambia la base lo mas probable sea q tenga el mismo aminoácido. La estructuración
esta determinada en el tercer nucleótido y la base que tienda a aparearse mas débil
en el complejo aminoácido aminoacil en el RNA, y se aparea el codon con el
anticodon, el anticodon lo da el RNA de
transferencia y el codon el ribosoma. Y como la tercera base se aparea mal,
queda la patita suelta, en relación a la fenilalanina se forma un aminoácido parecido.
ACTIVIDAD:
- Luego de haber leído y discutido en grupo la unidad, deberán realizar una síntesis sobre el tema el cual se abordará en clase.



grandioso blog!!
ResponderEliminarCreo que tuviste un pequeño error al decir que si el aminoácido es ácido tiene cargas positivas y viceversa, pero igualmente me fue de ayuda tu blog.
ResponderEliminar